Персонализированный подход в современной диагностике и лечении аллергии: молекулярные аспекты
Поражения клапанов сердца вследствие лучевой терапии злокачественных новообразований
04.08.2020
Калгари-Кембриджская модель медицинской консультации
06.08.20201. Дирекция образовательных программ «Медицина будущего» ФГАОУ ВО Первый
Московский государственный университет им. И.М. Сеченова МЗ РФ
2. Лечебный факультет ФГАОУ ВО Первый Московский государственный университет им.
И.М. Сеченова МЗ РФ
Резюме. Статья освещает актуальные вопросы, касающиеся персонализированного
подхода к современным диагностике и лечению аллергических заболеваний. Описаны
методы современной молекулярной диагностики аллергии: мультиплексный и
одноплексный анализы, дана характеристика аллергенам, используемым в последних.
Раскрыты основные понятия, касающиеся современного лечения аллергических
заболеваний: пассивная иммунизация IgG, использование антиген-содержащих
рекомбинантных вакцин и блокаторов IgEпри IgE-ассоциированных аллергических
заболеваниях. Освещены аспекты контроля проводимой болезнь-модифицирующей
терапии в его связи с персонализированным подходом к каждому конкретному пациенту.
Ключевые слова: аллергия, персонализированная медицина, иммунотерапия,
сенсибилизация, молекулярная диагностика
Abstract. The article covers issues of personalized approach to up-to-date diagnostics and
treatment of allergic diseases. Methods of current molecular diagnostics are described, including
singleplex and multiplex molecular assays and allergens that are mostly used in molecular assays.
Such up-to-date methods of treatment of allergic diseases as passive IgG immunization, antigencontaining recombinant vaccine administration, and IgE-blocking therapy in patients with IgEassociated allergic diseases are described. Personalized approach to disease-modifying therapy for
each patient suffering from allergic disease is discussed.
Key words: allergy, precision medicine, immunotherapy, sensitization, molecular
diagnostics
Термин «персонализированная медицина», непосредственно связанный с понятиями
о генотипе и фенотипе, постепенно становится неотъемлемой частью каждой медицинской
специальности. Данная структурная модель медицины подразумевает индивидуальный
подход к диагностике и лечению каждого пациента, основанный на детализированном
анализе молекулярно-генетических аспектов физиологии определенного человека [1, 23].
Аллергология, претерпевшая в последние годынастоящую «молекулярную
революцию», перерастающую в «клиническую эволюцию» диагностики и лечения
аллергических заболеваний, оказалось в самом эпицентре развития персонализированного
компонента современной медицины [2]. Обнаруженный в 1960 году IgE, отражающий
общую неспецифическую сенсибилизацию организма, в настоящее время потерял свое
самостоятельное значение в дифференцированном подходе к диагностике аллергических
заболеваний, когда еще в 1980-х была освоена технология молекулярного клонирования на
основе ДНК, позволяющая создавать рекомбинантные химические субстанции, способные
выявлять гиперчувствительность к каждому конкретному компоненту аллергена. Данный
метод, получивший название молекулярная диагностика, позволяет избежать зачастую
нецелесообразного недифференцированного подхода к диагностике и так называемой
иммуно-терапии пациентов, единственном болезнь-модифицирующем варианте лечения,
требующем наличия детализированных диагностических результатов [3, 12].
Основы современной молекулярной диагностики аллергии
“Мультиплексная” и “одноплексная” методики: различия, практическое применение
В настоящее время существует два принципиально разных подхода молекулярной
диагностики аллергии: «одноплексный» (singleplexassay) и «мультиплексный» (multiplexassay). Первый подразумевает под собой определение сенсибилизации организма
с помощью ИФА (иммуно-ферментный анализ), оцениваемой по уровню сывороточного
IgE,с использованием набора аллергенов (к которым предполагается наличие
аллергической реакции: пищевые, респираторные), связанных с помощью специальных
молекулярных «мостиков» и фиксированных на определенном веществе-носителе [20, 36].
Практически используемые «одноплексные» технологии представлены в таблице 1.
«Мультиплексный» (параллельный) анализ подразумевает под собой использование
так называемых микрочипов с фиксированными на них рекомбинантными или
высокоочищенными натуральными аллергенами с определением IgEи IgG(блокирующих
или усиливающих действие IgE), специфически связывающих данные молекулы [10].
Данный метод позволяет выявить детализированную сенсибилизацию организма к
каждому конкретному аллергену, определить перекрестную сенсибилизацию (связывание
одних и тех же антител (АТ) с эпитопами (участки молекулы аллергена, с которыми
связывается АТ) разных молекул), ко-сенсибилизацию (одновременную сенсибилизацию,
не относящуюся к перекрестной) и их дифференциальную диагностику. Преимуществом
такой технологии является использование малых объемов плазмы с определением
широкого спектра необходимых аллерген-специфических реакций организма[6, 22, 25, 35].
Практически используемые «мультиплексные» технологии представлены в таблице 2.
Рекомбинантные аллергены и компоненты натуральных экстрактов: использование
и трактовка результатов
Для проведения иммунологических тестов используются два вида аллергенов:
натуральные экстракты и рекомбинантные молекулы (при этом большинство аллергенов,
существующих в природе и используемых в диагностике аллергии – пептиды: исключение
составляют молекулы, являющиеся гаптенами (например, пенициллин). В диагностических
панелях молекулы имеют особую номенклатуру: обозначения веществ состоят из первых
трех букв латинского названия семейства аллергена (например, аллерген березы Betv
1,2,3,4,5- Betulavirtuosa). При этом аллергены, вызывающие перекрестную
сенсибилизацию, обозначаются одинаковой цифрой (напримерBetv 1 и Cora 1 – пищевой
аллерген фундука). Оценка результатов практическим врачом заключается в сопоставлении
клинических проявлений аллергии и лабораторных данных, полученных вышеуказанными
методами с использованием рекомендаций Европейской ассоциации аллергологов по
трактовке данных, полученных при применении рекомбинантных молекул и натуральных
экстрактов, когда они оказываются противоречивыми [4, 16, 27, 37].
Клинико-эпидемиологический подход к молекулярной диагностике аллергии
Переоценить методы молекулярной диагностики аллергии относительно понятия
«персонализированная медицина невозможно»: в настоящее время трактовка результатов
последних приобрела принципиально новое, клинико-эпидемиологическое значение. В
феврале 2017 года разработчики мультиплексной технологии молекулярной диагностики
аллергии MeDALL (от англ. Mechanismofthedevelopmentofallergy – механизм развития
аллергии) анонсировали данные, свидетельствующие о прогностическом характере
результатов, полученных таким методом, связанном с возможностью определения двух
фенотипов пациентов, страдающих аллергией: моносенсибилизированные и
полисенсибилизированные. Компания провела молекулярно-биологическое, ,
генетическое, клиническое и эпидемиологическое исследование, в результате которого
было обнаружено, что основываясь на данных о фенотипе, связанном с
гиперчувствительностью к набору определенных аллергенов, можно спрогнозировать риск
развития бронхиальной астмы у пациентов (что особенно актуально у детей раннего
возраста) и скорректировать в связи с этим режим иммунотерапии пациента. Алгоритмы
трактовки результатов, полученных методом MeDALLотражены в соответствующих
рекомендациях Европейской ассоциации аллергологов относительно данной технологии[5,
31].
Современные методы лечения аллергии: персонализированный подход
Молекулярна революция в аллергологии затронула и методы лечения аллергии. Давно
известно, что традиционно применяющаяся базовая терапия (H1-гистаминоблокаторы,
мембраностабилизаторы, ГКС и др.) является симптом-нивелирующей и не воздействует
непосредственно на причину возникновения клинических проявлений. Единственным
методом болезнь-модифицирующей терапии является иммунотерапия аллергических
заболеваний, появившаяся следом за разработкой методов молекулярной дифференцированной диагностики и требующая индивидуального, персонализированного
подхода к своему использованию[13, 21].
Пассивная иммунизация IgG
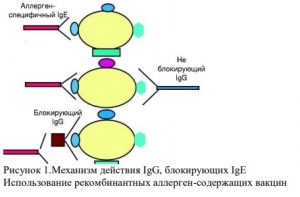
В настоящее время известно, что АТ класса G (IgG) способны конкурентно
связываться с эпитопами аллергенов, вызывающих клинические проявления аллергии при
их связывании с IgE (рис. 1). В связи с этим был разработан метод пассивной иммунизации
— введение IgG, связывающих конкретные аллергены (гиперчувствительность к которым
была выявлена при мультиплексном молекулярном анализе), и предотвращающих развитие
симптомов[6]. Таким образом, используя результаты методов молекулярной диагностики
аллергии вкупе с индивидуально подобранным набором вводимых IgG, можно добиться
своеобразной «иррадиации» лежащих в основе патогенеза аллергии IgEв каждом
конкретном клиническом случае [28, 33, 34].
Появление методов молекулярной диагностики аллергии и синтеза рекомбинантных
аллергенов позволило использовать последние в качестве рекомбинантных вакцин,
действие которых основано на подкожном введении молекул, идентичных аллергенам, но
не способных вызвать полноценную иммунную реакцию, а призванным лишь
индуцировать специфические IgG, блокирующие соответствующие IgE, выступающие в
качестве главного патогенетического звена в развитии клинических проявлений аллергии.
Подавляя действие IgE, IgGтаким образом становятся главным эффекторным звеном
данного вида иммунотерапии[17]. Патогенетическидествие таких вакцин аналогично
использованию блокирующих IgGв качестве альтернативной иммунотерапии
аллергических заболеваний. Примером служит вакцина под названием BM32, содержащая
аллергены пыльцы Phlp 1, Phlp 2, Phlp 5 и Phlp 6 (grasspollenallergy)[7,14,18, 19, 29, 30].
Ig-Eассоциированный и IgE-неассоциированный механизм: диагностическое
значение
Еще одним методом болезнь-модифицирующей иммунотерапии является
применение моноклональных антител к IgE(омализумаб) и Т-лимфоцитам (циклоспорин,
таклоримус). Применение данных препаратов основано на предшествующей лечению
тщательной дифференциальной диагностике IgE-ассоциированных и IgEнеассоциированных вариантов развития аллергии, для чего используются реакции
взаимодействия рекомбинантных антигенов со специфическими IgE, а также CD8 и CD4
лимфоцитами invivo, выявляющие патогенез развития аллергии у данного пациента. При
этом обнаружено, что наиболее часто IgE-неассоциированный механизм является ведущим
в возникновении атопического дерматита, что свидетельствует о необходимости
использования молекулярных методов диагностики перед началом иммунотерапии последнего[8, 18, 24, 26, 32].
Контроль иммунотерапии аллергических заболеваний: молекулярные аспекты
Немаловажным аспектом персонализированной диагностики и последующей
иммунотерапии аллергических заболеваний является лабораторно-клинический контроль
последней. С этой целью были предложены многочисленные методы, включающие
определение уровня цитокинов, имеющих отношение к патогенезу аллергических реакций
(интерлейкин-10, фактор некроза опухоли), клеточных маркеров (тесты активации
базофилов, Т-лимфоцитов), специфических по отношению к конкретному аллергену IgE.
Однако наибольшую эффективность показалоопределение в сыворотке крови пациента
уровня блокирующих IgG 4 класса[15]. При этом современные исследования
свидетельствуют о целесообразности использования мультиплексных диагностических
методов с применением микрочипов, содержащих малые количества аллергенов: при
применении одноплексных диагностических систем неизбежно образование избытка
антигенов, мешающего определению истинного уровня IgG (необходимость малого
количество аллергенов обосновывается конкурентными взаимоотношениями связывания
блокирующих IgGи IgEс аллергенами) (рис. 2) [9, 11]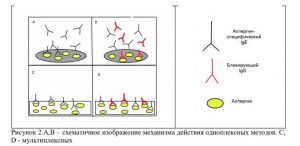
Вышеуказанное свидетельствует о том, что методы молекулярной диагностики
аллергии имеют свое принципиальное значение не только в предшествующей
иммунотерапии детальной, персонализированной диагностике механизмов развития
клинических проявлений у данного конкретного пациента, но и являются неотъемлемой
частью контроля иммунотерапии, способствующего наиболее целесообразной коррекции
последней.
Заключение
Таким образом, в настоящее время аллергология претерпела ряд принципиальных
изменений, касающихся подходу к диагностике и лечений ассоциированных с аллергией
состояний. Непонятные ранее патогенетические особенности развития отдельных
вариантов сенсибилизаций стали поддаваться не только детальной диагностике, связанной
с определением набора аллергенов, вызвавших гиперчувствительность, но и эффективной
иммунотерапии, зачастую имеющей явное преимущество перед традиционным симптоммодифицирующим лечением. Освоение методов рекомбинантного синтеза молекул и
разработка специализированных “противоаллергических” вакцин положила начало к
принципиально новому направлению аллергологии: персонализированной диагностике.
Все освещенные выше методы позволили свершиться абсолютному “прорыву” в подходах к ведению полисенсибилизированных пациентов, имеющих тяжелые, ранее не
поддающиеся терапии и качественной диагностике проявления аллергических заболеваний.
Список литературы
1. Riccio AM, De Ferrari L, Chiappori A et al.Molecular diagnosis and precision medicine in allergy
management. ClinChem Lab Med 2016; 54(11): 1705–1714
2. Matricardi PM, Kleine-Tebbe J, Hoffmann HJ et al. EAACI Molecular Allergology User’s Guide.
Pediatric Allergy and Immunology 2016: 27: (suppl23): 1–250
3. Canonica GW, Ansotegui IJ, Pawankar R et al. A WAO — ARIA — GALEN consensus document
on molecular-based allergy diagnostics. World Allergy Organization Journal 2013, 6:17.
4. Anto J.M., Bousquet J., Akdis Met al. Mechanisms of the Development of Allergy (MeDALL):
Introducing novel concepts in allergy phenotypes , Advances in allergen-microarray technology
for diagnosis and monitoring of allergy: The MeDALL allergen-chip. J Allergy ClinImmunol.
2017;139(2):388-399.
5. Flicker S, Linhart B, Wild C et al.Passive immunization with allergen-specific IgG antibodies for
treatment and prevention of allergy. Immunobiology. 2013;218(6):884-891.
6. Focke-Tejkl M, Weber M, Niespodziana K, et al. Development and characterization of a
recombinant, hypoallergenic, peptide-based vaccine for grass pollen allergy. J Allergy
ClinImmunol. 2015;135(5):1207-1207.
7. Campana R., Dzoro S., Mittermann Iet al.Molecular aspects of allergens in atopic dermatitis.
Wolters Kluwer Health, Inc. 1528-4050.
8. Lupinek C, Wollmann E, Valenta R. Monitoring Allergen Immunotherapy Effects by Microarray.
Curr Treat Options Allergy. 2016;3:189-203.
9. Szépfalusi Z, Bannert C, Ronceray L et al.Preventive sublingual immunotherapy in preschool
children: first evidence for safety and pro-tolerogenic effects. Pediatr Allergy Immunol.
2014;25(8):788-795.
10. Shamji MH, Kappen JH, Akdis M et al.Biomarkers for monitoring clinical efficacy of allergen
immunotherapy for allergic rhinoconjunctivitis and allergic asthma: an EAACI Position Paper.
Allergy. 2017;72(8):1156-1173.
11. Saltabayeva U, Garib V, Morenko Met al. Efficacy of Allergen Molecule-Based Diagnosis for
Prescription of Immunotherapy in an Area with Multiple Pollen Exposure. Int Arch Allergy
Immunol2017;173:93–98.
12. Becker S, Schlederer T, Kramer MF et al.Real-Life Study for the Diagnosis of House Dust Mite
Allergy – The Value of Recombinant Allergen-Based IgE Serology. nt Arch Allergy
Immunol2016;170:132–137.
13. Niederberger V, Marth K, Eckl-Dorna J et al.Skin test evaluation of a novel peptide carrier– based
vaccine, BM32, in grass pollen–allergic patients. J Allergy ClinImmunol. 2015 136(4):1101-1103.
14. Selb R., Eckl-Dorna J., Vrtala Set al.An assay that may predict the development of IgG enhancing
allergen-specific IgE binding during birch immunotherapy. Allergy 2013; 68: 1199–1202/
15. Twaroch TE, Curin M, Sterflinger Ket al.Specific Antibodies for the Detection of
AlternariaAllergens and the Identification of Cross-Reactive Antigens in Other Fungi. Int Arch
Allergy Immunol.2016;170(4):269-278.
16. Valenta R, Campana R, Focke-Tejkl M, Niederberger V. Vaccine development for allergenspecific immunotherapy based on recombinant allergens and synthetic allergen peptides: Lessons
from the past and novel mechanisms of action for the future. J Allergy ClinImmunol. 2016;
137(2):351-357.
17. Valenta R, Campana R, Niederberger V. Recombinant allergy vaccines based on allergen-derived
B cell epitopes. Immunol Lett. 2017;189:19-26.
18. Dzoro S, Mittermann I, Resch-Marat Y et al. House dust mites as potential carriers for IgE
sensitization to bacterial antigens. Allergy. 2017.
19. Weber M., Niespodziana K., Linhart Bet al.Comparison of the immunogenicity of BM32, a
recombinant hypoallergenic B cell epitope-based grass pollen allergy vaccine with allergen
extract-based vaccines. J Allergy ClinImmunol. 2017.
20. van Hage M, Hamsten C, Valenta R. ImmunoCAP assays: Pros and cons in allergology. J Allergy
ClinImmunol. 2017;140(4):974-977.
21. Valenta R. Mucosal Lining Fluid Biomarkers in Asthma: Basis for Rational Use of New Targeted
Therapies?EBioMedicine.2017 ;19:12-13.
22. Garib V, Wollmann E, Djambekova G, Lemell Pet al. Possible effect of landscape design on IgE
recognition profiles of two generations revealed with micro-arrayed allergens. Allergy. 2017
;72(10):1579-1582
23. Hellings PW, Fokkens WJ, Bachert Cet al. Positioning the principles of precision medicine in care
pathways for allergic rhinitis and chronic rhinosinusitis — A EUFOREA-ARIA-EPOS-AIRWAYS
ICP statement. Allergy. 2017;72(9):1297-1305.
24. Lupinek C, Derfler K, Lee Set al. Extracorporeal IgEImmunoadsorption in Allergic Asthma:
Safety and Efficacy.EBioMedicine. 2017;17:119-133.
25. Berings M, Arasi S, De Ruyck N, et al. Reliable mite-specific IgE testing in nasal secretions by
means of allergen microarray. J Allergy ClinImmunol. 2017;140(1):301-303.
26. Asarnoj A, Hamsten C, Lupinek Cet al.Prediction of peanut allergy in adolescence by early
childhood storage protein-specific IgE signatures: The BAMSE population-based birth cohort. J
Allergy ClinImmunol. 2017;140(2):587-590.
27. Narayanan M, Freidl R, Focke-Tejkl M et al. B Cell Epitope Peptide Derived from the Major Grass
Pollen Allergen Phl p 1 Boosts Allergen-Specific Secondary Antibody Responses without
Allergen-Specific T Cell Help. J Immunol. 2017;198(4):1685-1695.
28. Freidl R, Gstoettner A, Baranyi Uet al.Blocking antibodies induced by immunization with a
hypoallergenic parvalbumin mutant reduce allergic symptoms in a mouse model of fish allergy. J
Allergy ClinImmunol. 2017;139(6):1897-1905.
29. Zieglmayer P, Focke-Tejkl M, Schmutz Ret al.Mechanisms, safety and efficacy of a B cell
epitope-based vaccine for immunotherapy of grass pollen allergy.EBioMedicine. 2016;11:43-57.
30. Cornelius C, Schöneweis K, Georgi Fet al.Immunotherapy With the PreS-based Grass Pollen
Allergy Vaccine BM32 Induces Antibody Responses Protecting Against Hepatitis B
Infection.EBioMedicine. 2016;11:58-67.
31. Bousquet J, Anto JM, Akdis Met al.Paving the way of systems biology and precision medicine in
allergic diseases: the MeDALL success story: Mechanisms of the Development of ALLergy; EU
FP7-CP-IP; Project No: 261357; 2010-2015. Allergy. 2016;71(11):1513-1525.
32. Fedenko E, Elisyutina O, Shtyrbul Oet al.Microarray-based IgE serology improves management
of severe atopic dermatitis in two children. Pediatr Allergy Immunol. 2016;27(6):645-649.
33. Hochwallner H, Alm J, Lupinek Cet al.Transmission of allergen-specific IgG and IgE from
maternal blood into breast milk visualized with microarray technology. J Allergy ClinImmunol.
2014;134(5):1213-1215.
34. Olivieri M, Biscardo CA, Palazzo Petal. Wheat IgE profiling and wheat IgE levels in bakers with
allergic occupational phenotypes.Occup Environ Med. 2013;70(9):617-622.
35. Lupinek C, Marth K, Niederberger Vet al. Analysis of serum IgE reactivity profiles with
microarrayed allergens indicates absence of de novo IgE sensitizations in adults. J Allergy
ClinImmunol. 2012; 130(6):1418-1420.
36. Hochwallner H, Schulmeister U, Swoboda Iet al.Microarray and allergenic activity assessment of
milk allergens.ClinExp Allergy. 2010;40(12):1809-1818.
37. Harwanegg C, Laffer S, Hiller Ret al. Microarrayed recombinant allergens for diagnosis of
allergy.ClinExp Allergy. 2003;33(1):7-13.